Перейти к:
Переход к персонализированной психиатрии: зарубежный опыт психофармакогенетики
https://doi.org/10.17803/lexgen-2025-4-2-76-93
Аннотация
Статья посвящена изучению зарубежного опыта перехода к персонализированной психиатрии посредством психофармакогенетического подхода. Авторы рассматривают современные тенденции развития генетически ориентированного лечения психиатрических расстройств, акцентируя внимание на международных исследованиях последних десятилетий.
Обзор существующих научных публикаций показывает возрастающий интерес к индивидуализированному назначению лекарственных препаратов, основанному на генетическом профиле пациента. Это направление призвано повысить эффективность терапии и снизить риск побочных эффектов.
Цель исследования – оценить успешность внедрения психофармакогенетики в зарубежных странах. Для достижения поставленной цели проведен систематический обзор научной литературы, включая сбор данных о методиках диагностики, протоколах назначения лекарств и клинических исходах. Использованы статистические методы анализа больших объемов данных.
Выявлено значительное повышение эффективности лечения ряда психиатрических заболеваний благодаря применению психофармакогенетических подходов. Получены убедительные доказательства преимуществ индивидуального подбора дозировок антидепрессантов и антипсихотиков.
Психофармакогенетика представляет собой перспективное направление современной психиатрии, способствующее улучшению качества жизни пациентов. Необходимы дальнейшие клинические испытания и внедрение соответствующих технологий в практику здравоохранения.
Ограничениями являются небольшие размеры исследуемых групп населения и недостаточная репрезентативность выборок, что требует осторожности при экстраполяции полученных выводов на широкие слои населения.
Ключевые слова
Для цитирования:
Захарова Н.В., Насырова Р.Ф. Переход к персонализированной психиатрии: зарубежный опыт психофармакогенетики. Lex Genetica. 2025;4(2):76-93. https://doi.org/10.17803/lexgen-2025-4-2-76-93
For citation:
Zakharova N.V., Nasyrova R.F. Towards Personalized Psychiatry: Foreign Experience in Psychopharmacogenetics. Lex Genetica. 2025;4(2):76-93. (In Russ.) https://doi.org/10.17803/lexgen-2025-4-2-76-93
Введение
Фармакогенетика – новое направление клинической медицины, которое активно развивается в России и в мире. Безусловно, важны все факторы, влияющие на состояние организма, однако именно генетический анализ считается самой перспективной технологией, а фармакогенетический тест – прикладным инструментом персонализированной медицины (Neznanov et al., 2022).
Фармакогенетический тест в качестве медицинской технологии позволяет оказывать помощь в парадигме «4П: персонализация, предикция, превентивность и партисипативность», то есть заботиться о здоровье пациентов, исходя из индивидуальных (генетических) особенностей каждого человека с целью предотвращения как развития заболевания, так и риска осложнений при взаимной ответственности и активном участии самого пациента в процессе лечения (Alonso et al., 2019) с учетом уникальных для каждого человека генетически детерминированных метаболических процессов и лекарственных эффектов (ответ на лечение, эффективность купирующей или противорецидивной терапии, развитие нежелательных явлений или ятрогенных осложнений), которые на 20–95% определяют генные вариации (Arwood et al., 2016). Их изучение происходит в рамках фармакогенетики и фармакогеномики. Переход к персонализированному лечению осуществляется на основании выявленных биомаркеров заболеваний, то есть объективной оценки биологических функций или дисфункций на молекулярном, клеточном, органном и системном уровнях (Lydiard, Nemeroff, 2019).
Фармакогенетические тесты (ФГ-тесты) находят широкое применение в различных сферах медицины – бóльшая часть назначений приходится на онкологию (37%), за ней следуют инфекционные болезни (12%) и психиатрия (9%) (p<0,00001) (рис.) (Varnai et al., 2020).
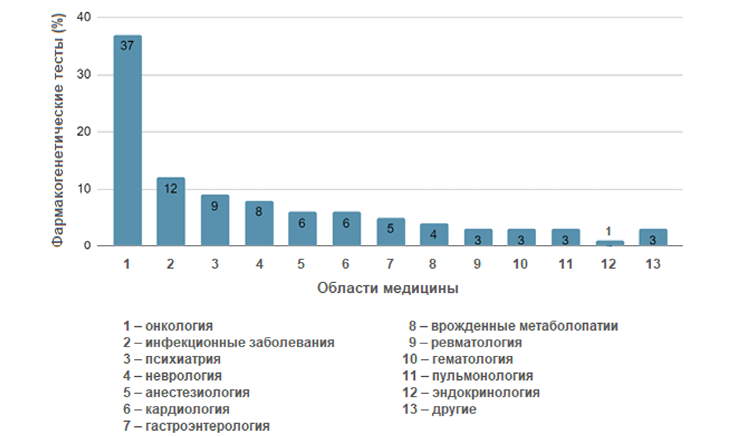
Рисунок. Частота назначения фармакогенетического тестирования в различных областях медицины (Varnai et al., 2020).
Figure. RFrequency of pharmacogenetic testing prescriptions in different areas of medicine (Varnai et al., 2020).
При анализе научной литературы можно проследить эволюцию представлений за последние 10–15 лет: от скептических (Howland, 2014) или необоснованно оптимистичных (Brown et al., 2017) к обоснованно одобрительным (Molden, Jukić, 2021).
Задача ФГ-теста состоит в выявлении генетических вариаций, влияющих на распределение в тканях, действие на таргетные рецепторы, взаимодействие с метаболизирующими молекулами, скорость элиминации лекарственных препаратов для определения риска их токсичности или эффективности, что позволяет предиктивно оптимизировать терапию (Avilov et al., 2024).
В структуре Российского общества психиатров (РОП) экспертное сообщество по психофармакогенетике объединяется секцией персонализированной психиатрии РОП, основными целями которой являются разработка и внедрение в клиническую практику инновационных технологий персонализации терапии психических расстройств; реализация фундаментальных, экспериментальных, доклинических и клинических исследований в области психофармакогенетики и трансляция результатов в клиническую практику. Специалисты указанной секции, интегрируя ресурсы в приоритетных направлениях персонализированной психиатрии, при активном сотрудничестве и кооперации исследовательских команд работают в парадигме трансляционной медицины с единой линией «идея – лаборатория – производство – психиатрическая клиника». При этом речь идет не только о проведении научно-исследовательской работы, но и о широком распространении материалов для повышения квалификации специалистов: монографий, методических руководств и специализированного научного журнала Personalized Psychiatry and Neurology (https://www.jppn.ru/jour).
Юридическая легализация
На сегодняшний день отечественные регламенты ФГ-тестов регулируются следующими нормативными актами.
Выбор лекарственного средства и его дозы, пути введения, оценка взаимодействия с другими препаратами являются функцией лечащего врача как на амбулаторном, так и на стационарном этапах лечения согласно приказу Минздрава России от 24.11.2021 № 1094н «Об утверждении Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов»1.
Учет фармакогенетических особенностей пациента при назначении лекарственных средств предусмотрен в письме Минздрава России от 6 октября 2017 г. № 17-4/10/2-6989 «О клинических рекомендациях (протоколах лечения) по вопросам оказания медицинской помощи»2.
Приказ Минздрава России от 25 декабря 1997 г. № 380 «О состоянии и мерах по совершенствованию лабораторного обеспечения диагностики и лечения пациентов в учреждениях здравоохранения Российской Федерации»3 регламентирует проведение лабораторной диагностики.
Современные требования к инфраструктуре генетических лабораторий содержат Методические указания МУ 1.3.2569-09 Роспотребнадзора4.
Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации»5 касается необходимости оказания медицинской помощи на основании клинических рекомендаций (протоколов лечения), разработанных медицинскими профессиональными некоммерческими организациями и согласованных с главными внештатными специалистами Минздрава России. Ознакомиться с указанными рекомендациями можно на официальном сайте Минздрава России в разделе «Полезные ресурсы» в подразделе «Электронный рубрикатор клинических рекомендаций»6.
Проведение ФГ-тестирования входит и в сферу ответственности клинических фармакологов, что регламентировано приказом Минздрава России от 2 ноября 2012 г. № 575н «Об утверждении Порядка оказания медицинской помощи населению по профилю “клиническая фармакология”»7, согласно которому решение о направлении больного на консультацию к клиническому фармакологу принимает лечащий врач (узкий специалист, участковый терапевт или педиатр, семейный врач и т.д.) в случае подозрения на наличие и (или) выявление фармакогенетических особенностей.
Приказ Министерства труда и социальной защиты РФ от 14 марта 2018 г. № 145н «Об утверждении профессионального стандарта “Специалист в области клинической лабораторной диагностики”»8 разделяет категории специалистов клинико-диагностических лабораторий с медицинским и немедицинским образованием и определяет требования к доступу к исследованиям различной степени сложности и обязательное наличие свидетельства об аккредитации специалиста или сертификата специалиста.
Приказ Минздрава России от 3 августа 2012 г. № 66н «Об утверждении Порядка и сроков совершенствования медицинскими работниками и фармацевтическими работниками профессиональных знаний и навыков путем обучения по дополнительным профессиональным образовательным программам в образовательных и научных организациях»9 регламентирует возможность получения специальности «клиническая лабораторная диагностика» после прохождения профессиональной переподготовки при наличии иных основных и требующих дополнительной подготовки компетенций.
Приказом Минздравсоцразвития России от 23 апреля 2009 г. № 210н «О номенклатуре специальностей специалистов с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения Российской Федерации»10 утверждена номенклатура специальностей специалистов с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения Российской Федерации, согласно которой специальность «клиническая лабораторная диагностика» является основной специальностью, которую могут получить лица с дипломом о высшем образовании по специальностям «лечебное дело», «педиатрия», «медико-профилактическое дело», «стоматология», «медицинская биохимия», «медицинская биофизика», «медицинская кибернетика».
Несмотря на разработку перечисленных нормативных документов, задача внедрения ФГ-тестов остается нерешенной в России. Рассмотрим методологические аспекты внедрения психофармакогенетики с упором на опыт зарубежных коллег.
Базы знаний генетической информации
«Онлайн-каталог человеческих генов и генетических нарушений» (Online Mendelian Inheritance In Man – OMIM11) – объединенный международный проект, содержащий информацию о более чем 15 тыс. генетических вариаций, которые когда-либо вызвали то или иное заболевание.
Каталогизированные гены подразделяются на группы:
1) генетические вариации, гарантированно вызывающие заболевания;
2) генетические вариации с отношением шансов (odds ratio — OR) > 5, то есть высоким риском развития заболевания;
3) генетические вариации отдельных случаев заболеваний с неизвестным риском возможного повтора.
Минусы этой базы знаний:
- каталогизация по генам, но не по вариациям;
- бóльшая часть записей не содержит указаний на возникновение заболеваний у носителей аналогичной вариации.
«Энциклопедия однонуклеотидных полиморфизмов» (англ. a database of single nucleotide polymorphisms) (SNPedia12) – открытый для общего пользования портал, содержащий данные о порядка 8000 полиморфных вариаций:
- SNP с OR>5, то есть высокой прогностической ценностью в оценке риска патологии;
- SNP с OR<5, то есть низкой прогностической ценностью в оценке риска патологии;
- записи об отдельных SNP с информацией о риске без возможности привести абсолютные риски к относительным статистическим методам;
- SNP, для которых приводятся лишь описательные или качественные характеристики.
Портал, построенный по логике Wikipedia, позволяет пополнять информацию о значимости SNP в развитии заболеваний. Предлагаемая пользователями информация проходит модерацию с оценкой качества и достоверности, в последующем эти данные реплицируются или опровергаются другими исследователями.
«База знаний по фармакогеномике» (The Pharmacogenomics Knowledge Base – PharmGKB13) – комплексный ресурс, собирающий знания о реакциях организма, возникающих в ответ на воздействие лекарственных препаратов при различных генотипах. Портал имеет удобный и интуитивно понятный интерфейс со множеством перекрестных ссылок как на базы знаний о полиморфизмах, так и на первоисточники клинических испытаний ФГ-тестов. Сведения автоматически компонуются в клинические аннотации, понятные практикующим врачам, и в генетические аннотации для биологов.
«Лейденская открытая база данных вариаций» (Leiden Open Variation Database – LOVD14) – программное обеспечение, позволяющее хранить и обмениваться сведениями о генетических вариациях, участвующих в развитии заболеваний. Доступны не менее 40 различных модификаций этого продукта, содержащие записи и аннотации более чем о 20 тыс. вариациях.
Экспертные организации
Глобальная исследовательская сеть фармакогеномики (Pharmacogenomics Research Network – PGRN15) с 2000 г. инициирует и объединяет локальные и международные фармакогенетические исследования, представляет площадки для сотрудничества, обмена ресурсами и обучения специалистов, а также ведет просветительскую работу среди населения.
Консорциум по внедрению фармакогенетики (Clinical Pharmacogenetics Implementation Consortium – CPIC16) был основан в конце 2009 г. как совместный проект PharmGKB и PGRN. Рекомендации CPIC рецензируются экспертами в области фармакогенетики и публикуются в ведущих научных журналах (в сотрудничестве с Clinical Pharmacology and Therapeutics) с одновременной публикацией в PharmGKB дополнительной информации в виде ряда публикаций по отдельным генам (Johnson et al., 2011; Relling et al., 2011; Scott et al., 2011; Crews et al., 2012; Martin et al., 2012). CPIC предоставляет клинические руководства по назначению 87 препаратов по результатам фармакогенетических лабораторных тестов.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration – FDA17) c 2003 г. занимается исследованиями в области фармакогенетики. На сегодняшний день имеются рекомендации по корректировке дозы для более чем 160 лекарственных препаратов.
Для обоснованного выбора или коррекции лекарственной терапии целесообразно опираться на данные CPIC и FDA, использующие прогностическую ценность генетической информации о взаимодействии генов и лекарств (Luzum et al., 2017).
Голландская рабочая группа по фармакогенетике (The Dutch Pharmacogenetics Working Group — DPWG18) в составе Королевской голландской ассоциации фармацевтов существует с 2005 г. и пользуется собственными критериями и обозначениями уровней доказательности и клинической ценности фармакогенетических маркеров.
Европейское агентство по лекарственным средствам (European Medicines Agency – EMA19) в области фармакогенетики работает с 2014 г. (Ehmann et al., 2014), однако процедуры валидизации и внедрения в практику заметно отстают от результатов других экспертных сообществ, притом что активность в разных странах Европы неравномерная (например, в Венгрии разработка фармакогенетических тест-систем более высокая) (Varnai et al., 2020).
Канадская фармакогенетическая ассоциация по безопасности лекарств (The Canadian Pharmacogenomics Network for Drug Safety – CPNDS20) представляет собой многоцентровый консорциум по активному надзору и фармакогеномике. Была создана в 2004 г. с целью раскрыть прогностическое значение генетических маркеров эффективности и безопасности фармакотерапии. Разработка новых подходов к снижению риска развития нежелательных явлений проходит на базе 17 госпиталей в крупных городах Канады (Ross et al., 2010). Министерство здравоохранения Канады (Health Canada, Sante Canada — HCSC) дает рекомендации по дозированию препаратов в соответствии с генетическим профилем и особенностями метаболизма на портале обновляемой таблицы фармакогеномных биомаркеров лекарственных средств21. Активно участвует во внедрении фармакогенетических исследований в практику.
Агентство по фармацевтике и медицинскому оборудованию Японии (Pharmaceuticals and Medical Devices Agency – PMDA22) создано в 2004 г. и занимается одобрением лекарственных средств и медицинских устройств, надзором за их безопасностью после выхода на рынок и оказанием помощи при неблагоприятных последствиях для здоровья. C 2018 г. агентство предоставляет консультации по вопросам фармакогенетики и фармакогеномики, основанные на исследованиях других стран.
Французская национальная ассоциация (сеть) фармакогенетики (Réseau national de pharmacogénétique, RNPGx) занимается исследованиями в области фармакогенетики с 2011 года, а также содействует при внедрении рекомендаций по назначению лечения на основе результатов генетического тестирования совместно с министерством здравоохранения Франции (Barin-Le Guellec et al., 2020).
Консорциум фармакогенетических вариаций (Pharmacogene Variation Consortium – PharmVar23) – это международная группа экспертов, которая поддерживает систематическую номенклатуру аллельных вариаций генов, влияющих на метаболизм лекарств.
Деятельность перечисленных выше международных экспертных сообществ некоторое время оставалась самобытной – специалисты разных групп пользовались собственными критериями для оценки валидности биомаркеров. В таблице 1 представлены некоторые разногласия по обозначению экспертных рекомендаций при использовании результатов ФГ-тестов в практической работе врачей, касающиеся их уровня доказательности.
Таблица 1. Сопоставление уровней доказательной ценности генетических маркеров и их обозначения двух экспертных сообществ
Table 1. Comparison of the levels of evidential value of genetic markers and their designations of two expert communities
CPIC | PharmGKB | ||
Уровень доказательности | Обозначение | Уровень доказательности | Обозначение |
ФГ-тест необходимо учитывать перед назначением препарата | A | Высокий уровень доказательности | 1A 1B |
ФГ-тест может быть полезен при назначении препарата | B | Средняя степень доказательной базы | 2A 2В |
ФГ-тест малоинформативен | C | Слабая доказательная база | 3 |
Отсутствие или скудость данных | D | – | – |
Примечание. CPIC (Clinical Pharmacogenetics Implementation Consortium) – Консорциум по внедрению клинической фармакогенетики; PharmGKB (The Pharmacogenomics Knowledge Base) – База знаний по фармакогеномике.
Note: CPIC (Clinical Pharmacogenetics Implementation Consortium) – Consortium for the implementation of clinical pharmacogenetics; PharmGKB (The Pharmacogenomics Knowledge Base) – Knowledge base on pharmacogenomics.
Методологические сложности внедрения психофармакогенетических тестов
Методологические сложности внедрения фармакогенетических тестов в практическую медицину включают два раздела вопросов:
‒ этические и юридические нормы;
‒ процессы стандартизации рутинных процедур (Ward et al., 2019).
Последний раздел касается регулирования стандартов и, возможно, пересмотра образовательных программ и паспортов врачебных специальностей, а также расширенной санпросвет работы – популяризации методики среди пациентов.
Этические и юридические нормы
Опыт Комитета по этике Международного общества психиатрической геномики (International Society of Psychiatric Genetics (ISPG)24) приобретен благодаря совместной и согласованной деятельности ученых, клиницистов, генетиков и психиатров, пациентов, специалистов по биоэтике и юристов (Lázaro-Muñoz et al., 2019). Доктрина ISPG очерчивает три ключевые проблемы: этичность публикуемых результатов научных исследований, неразрешимые дилеммы клинической практики и нормативную правовую регламентацию фармакогенетических тестов.
Этика научных исследований
Этичность научных исследований строится согласно Хельсинкской декларации с опорой на социальную ответственность, под которой понимают прежде всего обеспечение научной целостности, прозрачности протокола и всех процедур, строгой отчетности и воспроизводимости результатов, а также уважение вклада других путем недопущения плагиата и использования добросовестной авторской практики. Кроме того, социальная ответственность в большей степени касается актуальности конкретных научных изысканий для удовлетворения реальных потребностей общества, что требует отдельного анализа.
Этика клинической практики
Анализ зарубежной литературы, проведенный в 2025 г. коллективом авторов, включает 129 публикаций (Neiders et al., 2025). Статьи представляют широкий спектр областей исследований: клиническую психологию, общую медицину, нейронауку, генетику, клиническую генетику, психиатрию и психическое здоровье, философию, этику и т. д. Большинство статей (83) представляют собой теоретические исследования, 35 статей сообщают о результатах эмпирических исследований, а 11 – обзорные статьи. Качественный тематический анализ включенных статей выявил четыре основные темы:
- Потенциальная польза или вред:
- риск ошибочной интерпретации,
- риск предвзятости интерпретаций,
- риски использования ИИ,
- риск дискриминации и стигматизации,
- риски коррупции и коммерциализации,
- реакции на прогнозы.
- Права и обязанности:
- информированное добровольное согласие,
- личная автономия и агентность,
- право знать и право не знать,
- защита персональных данных и конфиденциальность.
- Внедрение в клиническую рутину:
- руководства по надлежащей практике и стандартизация,
- повышение уровня осведомленности пациентов,
- новые стандарты образования медицинских работников,
- организационные вопросы сервиса и сопровождения.
- Особые этические нюансы:
- вопросы репродуктивного выбора и перинатального использования,
- применение у несовершеннолетних и недееспособных,
- осведомленность членов семей.
Теоретически потенциал фармакогенетики представляется монументальным в плане оптимизации терапевтических процессов за счет персонализированного прогнозирования безопасности и эффективности лекарств (Khera et al., 2018).
Однако если для пациентов, ранее не получавших лечения, результаты ФГ-тестирования, бесспорно, полезны, то для длительно принимавших препараты ФГ-тест может стать причиной некоторых проблем. Например, генетическое тестирование может выявить, что лекарство, которое было назначено пациенту, вероятно, будет менее эффективным или вызовет серьезные побочные эффекты по сравнению с другими. Такие результаты будут полезны в случаях отсутствия ремиссии и при показаниях для смены схемы терапии, но для пациентов в стабильном состоянии целесообразность изменения поддерживающей или противорецидивной стратегии (при таких результатах ФГ-теста) представляется неоднозначной. Причем риски тут двунаправленные: есть вероятность ухудшения состояния при смене терапевтической тактики, что повлечет увеличение бремени заболевания, но и напротив, отказ от смены терапии по результатам тестирования может стать причиной развития нежелательных явлений, рецидива расстройства (в том числе попытки суицида или инвалидизации), что может быть расценено как халатность.
За последние 25 лет количество лекарств, действие которых проверено в ходе фармакогенетических исследований, увеличилось с 5 до 50%, а линейка потенциальных фармакогенетических маркеров включает более 200 генов, кодирующих молекулы фармакокинетики и фармакодинамики этих препаратов.
Основные положения этических норм проведения психофармакогенетического тестирования определяет Комитет по этике Международного общества психиатрической геномики (ISPG), включающий биологов, клинических генетиков, психиатров и других специалистов сферы психического здоровья, пациентов, правозащитников и юристов (Lázaro-Muñoz et al., 2019).
Вопросы этики применения результатов фармакогенетического тестирования касаются нескольких плоскостей: во-первых, особые требования налагаются на научно-исследовательские коллективы, работающие в области психофармакогенетики; во-вторых, с определенными сложностями столкнется любой практикующий психиатр; в-третьих, необходимы решения социальных или организационных вопросов – с обучением специалистов, просвещением населения, расширением номенклатуры медицинских услуг и т.д.
Этические вопросы фармакогенетического тестирования в психиатрической практике
Научно-организационные аспекты внедрения генетических тестов в психиатрии
- Подтверждение выраженной ассоциации полиморфизма с риском неблагоприятного эффекта препарата (недостаточная эффективность или развитие нежелательного явления).
- Широкая распространенность полиморфизма в популяции.
- Определенные алгоритмы врачебных действий на основе ФГ-теста (предпочтительные препараты, режим дозирования, условия назначения сопутствующих лекарств).
- Доказанные преимущества назначения препарата по результатам ФГ-теста по сравнению с другими тактиками (Сычёв, 2018).
Большинство осведомленных врачей ожидает, что ФГ-тестирование станет общепризнанным стандартом (Thompson et al., 2015). Такие тенденции неумолимо приводят к постепенному внедрению ФГ-тестов в клиническую практику, что требует повышения квалификации с формированием соответствующих навыков и компетенций специалистов (Сычёв, 2018). Однако практикующие врачи сталкиваются со сложными этическими дилеммами, однозначных вариантов решения пока нет.
Клинико-этические дилеммы применения генетических тестов практикующими психиатрами
- Как сохранить доверие пациентов, снизив риск дискриминации25.
- Как развеять сомнения в сохранении конфиденциальности.
- Какова ответственность за внесение или невнесение генетической информации в историю болезни.
- Насколько целесообразно лечение на преморбидных стадиях26.
- Как сообщать или сохранять в тайне информацию о генетическом риске не психических болезней (например, онкологических).
- Какой алгоритм вовлечения пациентов и их родственников в процесс принятия решения о стратегии лечения на основании ФГ-тестов (Ward et al., 2019).
Административно-организационные сложности
С точки зрения организации системы здравоохранения и административного регулирования процессов внедрения ФГ-тестов в психиатрическую практику проблемы не менее сложные.
- Нужны образовательные стандарты для специалистов психофармакогенетики.
- Нужны профессиональные методические рекомендации.
- Необходимы новые правовые стандарты оказания медицинской помощи.
- Аудит доказательств клинической полезности до внедрения.
- Определение экономической целесообразности ФГ-тестирования (Ward et al., 2019).
При этом следует учитывать высокие требования критериев приемлемости для включения маркеров в стандарты оказания медицинской помощи:
- Высокая степень пенетрации в популяции.
- Доказанная прогностическая ценность.
- Тестирование дешевле других методов персонализации.
- Снижение общих затрат в случае его применения (Flowers and Veenstra, 2004).
Унификация стандартов
Медицинские термины, в том числе и фармакогенетические, должны легко интерпретироваться клиницистами, имеющими базовую подготовку в предметной области, и по возможности быть согласованными для генов, кодирующих белки с аналогичными функциями.
В 2017 г. было принято решение достигнуть международного консенсуса по методу Дельфи с соблюдением этических и юридических аспектов фармакогенетики при отсутствии каких-либо помех для согласования терминологии (Caudle et al., 2017). Метод Дельфи заключается в экспертной оценке группой не зависимых друг от друга профессионалов, но эта оценка должна проходить анонимно заочно и включать в себя несколько структурированных уровней получения информации с обязательной обратной связью. Процесс может состоять из мозговых штурмов, опросов и серии интервью в группах людей, которые не знакомы и не контактируют друг с другом. Если грамотно обобщить и обработать индивидуальные оценки квалифицированных экспертов по поводу ситуации, то можно получить коллективное мнение, обладающее достаточной степенью достоверности и надежности.
Стандартизированные понятия, обозначения и интерпретации ФГ-тестов составлены относительно недавно и постоянно обновляются по мере устранения некоторой путаницы терминов и стандартов (Kumar, Kearney, 2021; Yoshida, Müller, 2020; Bousman et al., 2021). Так, клинические рекомендации экспертных сообществ по фармакогенетическому тестированию, изложенные в таблице 2, представляются весьма разнородными, что следует учитывать при разработке клинических рекомендаций.
Таблица 2. Клинические рекомендации экспертных сообществ по фармакогенетическому тестированию
Table 2. Clinical recommendations of expert communities on pharmacogenetic testing
Препарат | Ген | Информация о ФГ-тестах | Рекомендации по дозам | Уровень доказательности | ||||
FDA | EMA | HCSC | PMDA | CPIC | Pharm GKB | |||
Арипипразол | CYP2D6 | Действующий | Действующий | Действующий | Н/д | – | B | 3 |
Клозапин | CYP2D6 | Действующий | Н/д | Н/д | Н/д | DPWG | C | Н/д |
HTR2C | – | – | – | – | – | D | 2B | |
CYP1A2 | – | – | – | – | – | – | – | |
Галоперидол | CYP2D6 | Н/д | Н/д | Н/д | Н/д | DPWG | C | 3 |
Оланзапин | CYP2D6 | Н/д | Информативный | Н/д | Н/д | DPWG | C | 3 |
HTR2C | – | – | – | – | – | D | 2B | |
Перфеназин | CYP2D6 | Действующий | Н/д | Н/д | Действующий | Н/д | Н/д | Н/д |
Пимозид | CYP2D6 | Обязательный | Н/д | Н/д | Н/д | Н/д | B | 4 |
Рисперидон | CYP2D6 | Информативный | Н/д | Информативный | Н/д | DPWG | B | 2A |
DRD2 | – | – | – | – | – | C | 2A | |
HTR2C | – | – | – | – | – | D | 2B | |
Тиоридазин | CYP2D6 | Действующий | Н/д | Н/д | Н/д | Н/д | C | 3 |
Зуклопентиксол | CYP2D6 | Н/д | Н/д | Н/д | Н/д | DPWG | C | 3 |
Примечание. Н/д — нет данных.
Note: Н/д – no data available.
Отдельного внимания требует стандартизация процессов цифровизации клинической практики с учетом работы с большими данными и развития технологий секвенирования и микрочипов (Demkow, Wolańczyk, 2017). Зарубежный опыт методологии масштабирования фармакогенетических тестов для выбора антидепрессантов свидетельствует о выполнимости этих задач (Salloum et al., 2022). Цифровые технологии значительно облегчают унифицированную интерпретацию результатов по стандартизованным протоколам и выступают в качестве вспомогательного инструмента (помощи принятия решений) при выборе препаратов и назначении оптимальных дозировок (Bousman et al., 2019). Причем экономическая целесообразность внедрения подтверждена результатами систематического обзора и предложена доказавшая эффективность методология масштабирования фармакогенетических тестов на примере антидепрессантов (Karamperis et al., 2021; Salloum et al., 2022).
Заключение
Подводя итоги обзора литературы, стоит привести ключевые направления и задачи на пути к внедрению фармакогенетических тестов в сфере психического здоровья: разработка обновленных образовательных программ по геномике для психиатров; создание практических руководств, учитывающих потенциальные клинические, психологические и социальные последствия психиатрической геномики; продвижение модели интегрированной помощи для управления генетикой в психиатрии с обязательным активным участием пациента при его информированном согласии на проведение геномного тестирования. Польза психофармакогенетики во многом зависит от базовых врачебных знаний и навыков по интерпретации результатов, критической оценке доказательной базы для разных маркеров.
Способствовать внедрению психофармакогентического тестирования могут несколько факторов: представления о его клинической ценности как здоровьесберегающего метода, осведомленная заинтересованность пациентов, повышение комплаенса при оптимизации лечения. При этом надо учитывать несколько барьеров на этом пути: точный расчет экономической целесообразности, дефицит экспертов и специалистов для разработки клинических рекомендаций и руководств, риск ошибочных интерпретаций. Особо стоит выделить риски этического толка: риск дискриминации по генетическим маркерам, распространенное мнение об утрате способности к клиническому мышлению практикующих врачей.
Фармакогенетическое тестирование следует рассматривать как инструмент поддержки принятия решений, помогающий вдумчивому практикующему врачу улучшить качество оказываемой помощи, но не как альтернативу стандартным протоколам лечения. В этом контексте генетические маркеры дополняют не только знания о динамике заболевания и проводимой психофармакотерапии, но и демографическую информацию (например, возраст, пол, семейный анамнез), клиническую (например, сопутствующие лекарства) и информацию об образе жизни (например, диета, курение), что помогает выстраивать оптимальный режим лечения и реабилитации.
Открытые для общего ознакомления ресурсы содержат колоссальное количество информации об использовании генетических тестов при назначении психофармакотерапии. Специалисты вынуждены самостоятельно постигать новые знания и изучать мнения множества экспертов, прежде чем начать с уверенностью пользоваться всеми возможностями психофармакогенетики. Однако, учитывая стремительное накопление результатов отдельных рандомизированных контролируемых исследований и проведение крупномасштабных фармакогенетических исследовательских проектов, в обозримом будущем мы станем свидетелями развития персонализированной психиатрии на практике.
1 Приказ Минздрава России от 24.11.2021 № 1094н «Об утверждении Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов» (Зарегистрировано в Минюсте России 30.11.2021 № 66124). Режим доступа: https://www.consultant.ru/document/cons_doc_LAW_401865/
2 Письмо Минздрава России от 06.10.2017 № 17-4/10/2-6989 «О клинических рекомендациях (протоколах лечения) по вопросам оказания медицинской помощи». Режим доступа: https://www.consultant.ru/document/cons_doc_LAW_319682/
3 Приказ Минздрава РФ от 25 декабря 1997 г. № 380 «О состоянии и мерах по совершенствованию лабораторного обеспечения диагностики и лечения пациентов в учреждениях здравоохранения Российской Федерации». Режим доступа: https://base.garant.ru/4173965/
4 Методические указания МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ 22 декабря 2009 г.). Режим доступа: https://base.garant.ru/70180116/
5 Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011 № 323-ФЗ (последняя редакция). Режим доступа: https://www.consultant.ru/document/cons_doc_LAW_121895/
6 Рубрикатор клинических рекомендаций. Режим доступа: https://cr.minzdrav.gov.ru
7 Приказ Министерства здравоохранения РФ от 2 ноября 2012 г. № 575н «Об утверждении Порядка оказания медицинской помощи по профилю “клиническая фармакология”. Режим доступа: https://base.garant.ru/70288220/
8 Приказ Министерства труда и социальной защиты РФ от 14 марта 2018 г. № 145н «Об утверждении профессионального стандарта “Специалист в области клинической лабораторной диагностики”». Режим доступа: https://www.garant.ru/products/ipo/prime/doc/71813892/
9 Приказ Министерства здравоохранения РФ от 3 августа 2012 г. № 66н «Об утверждении Порядка и сроков совершенствования медицинскими работниками и фармацевтическими работниками профессиональных знаний и навыков путем обучения по дополнительным профессиональным образовательным программам в образовательных и научных организациях». Режим доступа: https://base.garant.ru/70222886/
10 Приказ Министерства здравоохранения и социального развития РФ от 23 апреля 2009 г. № 210н «О номенклатуре специальностей специалистов с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения Российской Федерации». Режим доступа: https://www.garant.ru/products/ipo/prime/doc/12067496/-ФЗ
11 Online Mendelian Inheritance in Man (OMIM). Available at: https://omim.org
12 SNPedia. Available at: https://snpedia.com
13 The Pharmacogenomics Knowledge Base (PharmGKB). Available at: https://www.pharmgkb.org
14 Leiden Open Variation Database (LOVD). Available at: https://www.lovd.nl/2.0/index_list.php
15 Pharmacogenomics Global Research Network (PGRN). Available at: https://www.pgrn.org
16 Clinical Pharmacogenetics Implementation Consortium (CPIC). Available at: https://cpicpgx.org
17 Food and Drug Administration (FDA). Available at: https://www.fda.gov
18 The Dutch Pharmacogenetics Working Group (DPWG). Available at: https://www.knmp.nl/dossiers/farmacogenetica
19 European Medicines Agency (EMA). Available at: https://www.ema.europa.eu/en/homepage
20 The Canadian Pharmacogenomics Network for Drug Safety (CPNDS). Available at: https://cpnds.ubc.ca
21 The Drug Product Database (DPD). Available at: https://www.canada.ca/en/health-canada/services/drugs-health-products/drug-products/drug-product-database/more-info.html
22 Pharmaceuticals and Medical Devices Agency (PMDA). Available at: https://www.pmda.go.jp
23 Pharmacogene Variation Consortium (PharmVar). Available at: https://www.pharmvar.org
24 International Society of Psychiatric Genetics (ISPG). Available at: https://ispg.net
25 В 2008 г. принят международный Закон о недопустимости дискриминации по генетическим признакам (Genetic Information Nondiscrimination Act, GINA) (Health law – genetics – Congress restricts use of genetic information by insurers and employers. – Genetic Information Nondiscrimination Act of 2008, Pub. L. No. 110-233, 122 Stat. 881 (to be codified in scattered sections of 26, 29, and 42 U.S.C.). (2009). Harvard law review, 122(3), 1038–1045. Available at: https://pubmed.ncbi.nlm.nih.gov/19288615/), однако в большинстве стран отмечается status quo в его правоприменении (Joly et al., 2017).
26 Пенетрантность известных геномных вариантов, связанных с психическими расстройствами, низкая: у лиц с положительными результатами по генетическим признакам высокого риска развития психозов редко наблюдаются состояния, соответствующие критериям заболевания. Кроме того, нет надежных указаний на возможность предотвратить манифестный психоз, начиная лечение на бессимптомной стадии.
Список литературы
1. Alonso, S.G., de la Torre Díez, I., Zapiraín, B.G. (2019). Predictive, personalized, preventive and participatory (4P) medicine applied to telemedicine and eHealth in the literature. Journal of Medical Systems, 43, 140. https://doi.org/10.1007/s10916-019-1279-4
2. Arwood, M.J., Chumnumwat, S., Cavallari, L.H., Nutescu, E.A., Duarte, J.D. (2016). Implementing pharmacogenomics at your institution: establishment and overcoming implementation challenges. Clinical and translational science, 9(5), 233–245. https://doi.org/10.1111/cts.12404
3. Avilov, A.Y., Kidyaeva, A.V., Vaiman, E.E. (2024). Predictive Pharmacogenetic Testing in Psychiatry: Pros and Cons. Personalized Psychiatry and Neurology, 4(1), 40–49. https://doi.org/10.52667/10.52667/2712-9179-2024-4-1-40-49
4. Barin-Le Guellec, C., Picard, N., Alarcan, H., Barreau, M., Becquemont, L., Quaranta, S., ... Loriot, M. A. (2020). La pharmacogénétique au service du soin en France: une discipline qui évolue!. Therapies, 75(5), 459–470. https://doi.org/10.1016/j.therap.2019.09.006
5. Bousman, C.A., Bengesser, S.A., Aitchison, K.J., Amare, A.T., Aschauer, H., Baune, B.T., ... Müller, D.J. (2021). Review and consensus on pharmacogenomic testing in psychiatry. Pharmacopsychiatry, 54(01), 5–17. https://doi.org/10.1055/a-1288-1061
6. Bousman, C., Al Maruf, A., Müller, D.J. (2019). Towards the integration of pharmacogenetics in psychiatry: a minimum, evidence-based genetic testing panel. Current opinion in psychiatry, 32(1), 7–15. https://doi.org/10.1097/YCO.0000000000000465
7. Brown, L.C., Lorenz, R.A., Li, J., Dechairo, B.M. (2017). Economic utility: combinatorial pharmacogenomics and medication cost savings for mental health care in a primary care setting. Clinical Therapeutics, 39(3), 592–602. https://doi.org/10.1016/j.clinthera.2017.01.022
8. Caudle, K.E., Dunnenberger, H.M., Freimuth, R.R., Peterson, J.F., Burlison, J.D., Whirl-Carrillo, M., ... Hoffman, J.M. (2017). Standardizing terms for clinical pharmacogenetic test results: consensus terms from the Clinical Pharmacogenetics Implementation Consortium (CPIC). Genetics in Medicine, 19(2), 215–223. https://doi.org/10.1038/gim.2016.87
9. Crews, K.R., Gaedigk, A., Dunnenberger, H.M., Klein, T.E., Shen, D.D., Callaghan, J.T., ... Skaar, T.C. (2012). Clinical Pharmacogenetics Implementation Consortium (CPIC) guidelines for codeine therapy in the context of cytochrome P450 2D6 (CYP2D6) genotype. Clinical Pharmacology & Therapeutics, 91(2), 321–326. https://doi.org/10.1038/clpt.2011.287
10. Demkow, U., Wolańczyk, T. (2017). Genetic tests in major psychiatric disorders—integrating molecular medicine with clinical psychiatry–why is it so difficult?. Translational psychiatry, 7, e1151. https://doi.org/10.1038/tp.2017.106
11. Ehmann, F., Caneva, L., Papaluca, M. (2014). European Medicines Agency initiatives and perspectives on pharmacogenomics. British journal of clinical pharmacology, 77(4), 612–617. https://doi.org/10.1111/bcp.12319
12. Flowers, C.R., Veenstra, D. (2004). The role of cost-effectiveness analysis in the era of pharmacogenomics. Pharmacoeconomics, 22, 481–493. https://doi.org/10.2165/00019053-200422080-00001
13. Howland, R.H. (2014). Pharmacogenetic testing in psychiatry: not (quite) ready for primetime. Journal of psychosocial nursing and mental health services, 52(11), 13–16. https://doi.org/10.3928/02793695-20141021-09
14. Johnson, J.A., Gong, L., Whirl‐Carrillo, M., Gage, B.F., Scott, S.A., Stein, C.M., ... Altman, R.B. (2011). Clinical Pharmacogenetics Implementation Consortium Guidelines for CYP2C9 and VKORC1 genotypes and warfarin dosing. Clinical Pharmacology & Therapeutics, 90(4), 625–629. https://doi.org/10.1038/clpt.2011.185
15. Joly, Y., Feze, I.N., Song, L., Knoppers, B.M. (2017). Comparative approaches to genetic discrimination: chasing shadows?. Trends in Genetics, 33(5), 299–302. https://doi.org/10.1016/j.tig.2017.02.002
16. Karamperis, K., Koromina, M., Papantoniou, P., Skokou, M., Kanellakis, F., Mitropoulos, K., ... Mitropoulou, C. (2021). Economic evaluation in psychiatric pharmacogenomics: a systematic review. The pharmacogenomics journal, 21, 533–541. https://doi.org/10.1038/s41397-021-00249-1
17. Khera, A. V., Chaffin, M., Aragam, K.G., Haas, M.E., Roselli, C., Choi, S.H., ... Kathiresan, S. (2018). Genomewide polygenic scores for common diseases identify individuals with risk equivalent to monogenic mutations. Nature genetics, 50, 1219–1224. https://doi.org/10.1038/s41588-018-0183-z
18. Kumar, A., Kearney, A. (2021). The use of pharmacogenetic testing in psychiatry. Journal of the American Association of Nurse Practitioners, 33(11), 849–851. https://doi.org/10.1097/JXX.0000000000000666
19. Lázaro‐Muñoz, G., Sabatello, M., Huckins, L., Peay, H., Degenhardt, F., Meiser, B., ... ISPG Ethics Committee. (2019). International society of psychiatric genetics ethics committee: issues facing us. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 180(8), 543–554. https://doi.org/10.1002/ajmg.b.32736
20. Luzum, J.A., Pakyz, R.E., Elsey, A.R., Haidar, C.E., Peterson, J.F., Whirl‐Carrillo, M., ... Pharmacogenomics Research Network Translational Pharmacogenetics Program. (2017). The pharmacogenomics research network translational pharmacogenetics program: outcomes and metrics of pharmacogenetic implementations across diverse healthcare systems. Clinical Pharmacology & Therapeutics, 102(3), 502–510. https://doi.org/10.1002/cpt.630
21. Lydiard, J., Nemeroff, C.B. (2019). Biomarker-guided tailored therapy. In: Kim, Y.K. (ed.). Frontiers in Psychiatry. Advances in Experimental Medicine and Biology (Vol 1192, pp. 199–224). Singapore: Springer Singapore. https://doi.org/10.1007/978-981-32-9721-0_10
22. Martin, M.A., Klein, T.E., Dong, B.J., Pirmohamed, M., Haas, D.W., Kroetz, D.L. (2012). Clinical pharmacogenetics implementation consortium guidelines for HLA‐B genotype and abacavir dosing. Clinical Pharmacology & Therapeutics, 91(4), 734–738. https://doi.org/10.1038/clpt.2011.355
23. Molden, E., Jukić, M.M. (2021). CYP2D6 reduced function variants and genotype/phenotype translations of CYP2D6 intermediate metabolizers: implications for personalized drug dosing in psychiatry. Frontiers in Pharmacology, 12, 650750. https://doi.org/10.3389/fphar.2021.650750
24. Neiders, I., Mežinska, S., van Haren, N.E. (2025). Ethical and social issues in prediction of risk of severe mental illness: a scoping review and thematic analysis. BMC psychiatry, 25, 501. https://doi.org/10.1186/s12888-025-06949-3
25. Neznanov, N.G., Nasyrova, R.F., Shnayder, N.A. (2022). From classical to personalized psychoneurology. Personalized Psychiatry and Neurology, 2(1), 1–3. https://doi.org/10.52667/2712-9179-2022-2-1-1-3
26. Relling, M.V., Gardner, E.E., Sandborn, W.J., Schmiegelow, K., Pui, C.H., Yee, S.W., ... Klein, T.E. (2011). Clinical Pharmacogenetics Implementation Consortium guidelines for thiopurine methyltransferase genotype and thiopurine dosing. Clinical Pharmacology & Therapeutics, 89(3), 387–391. https://doi.org/10.1038/clpt.2010.320
27. Ross, C.J., Visscher, H., Sistonen, J., Brunham, L.R., Pussegoda, K., Loo, T.T., ... Hayden, M.R. (2010). The Canadian Pharmacogenomics Network for Drug Safety: a model for safety pharmacology. Thyroid, 20(7), 681–687. https://doi.org/10.1089/thy.2010.1642
28. Salloum, R.G., Bishop, J.R., Elchynski, A.L., Smith, D.M., Rowe, E., Blake, K.V., ... Tuteja, S. (2022). Best–worst scaling methodology to evaluate constructs of the Consolidated Framework for Implementation Research: application to the implementation of pharmacogenetic testing for antidepressant therapy. Implementation science communications, 3(1), 52. https://doi.org/10.1186/s43058-022-00300-7
29. Scott, S.A., Sangkuhl, K., Gardner, E.E., Stein, C.M., Hulot, J.S., Johnson, J.A., ... Shuldiner, A.R. (2011). Clinical Pharmacogenetics Implementation Consortium guidelines for cytochrome P450–2C19 (CYP2C19) genotype and clopidogrel therapy. Clinical Pharmacology & Therapeutics, 90(2), 328–332. https://doi.org/10.1038/clpt.2011.132
30. Thompson, C., Hamilton, S.P., Hippman, C. (2015). Psychiatrist attitudes towards pharmacogenetic testing, direct-to-consumer genetic testing, and integrating genetic counseling into psychiatric patient care. Psychiatry Research, 226(1), 68–72. https://doi.org/10.1016/j.psychres.2014.11.044
31. Varnai, R., Szabo, I., Tarlos, G., Szentpeteri, L.J., Sik, A., Balogh, S., Sipeky, C. (2020). Pharmacogenomic biomarker information differences between drug labels in the United States and Hungary: implementation from medical practitioner view. The Pharmacogenomics Journal, 20, 380–387. https://doi.org/10.1038/s41397-019-0123-z
32. Ward, E.T., Kostick, K.M., Lázaro-Muñoz, G. (2019). Integrating genomics into psychiatric practice: ethical and legal challenges for clinicians. Harvard review of psychiatry, 27(1), 53–64. https://doi.org/10.1097/HRP.0000000000000203
33. Yoshida, K., Müller, D.J. (2019). Pharmacogenetics of antipsychotic drug treatment: update and clinical implications. Molecular Neuropsychiatry, 5(Suppl. 1), 1–26. https://doi.org/10.1159/000492332
34. Сычёв, Д.А. (2018). Эксперт по персонализированной медицине – специалист будущего. Фармакогенетика и фармакогеномика, (2), 3–3 https://www.pharmacogenetics-pharmacogenomics.ru/jour/article/view/80
Об авторах
Н. В. ЗахароваРоссия
Наталья В. Захарова, кандидат медицинских наук, ведущий научный сотрудник Института персонализированной психиатрии и неврологии; ведущий эксперт Научно-образовательного центра нейропсихиатрии
Санкт-Петербург; Самара
Р. Ф. Насырова
Россия
Регина Ф. Насырова, доктор медицинских наук, руководитель Института персонализированной психиатрии и неврологии
Санкт-Петербург
Рецензия
Для цитирования:
Захарова Н.В., Насырова Р.Ф. Переход к персонализированной психиатрии: зарубежный опыт психофармакогенетики. Lex Genetica. 2025;4(2):76-93. https://doi.org/10.17803/lexgen-2025-4-2-76-93
For citation:
Zakharova N.V., Nasyrova R.F. Towards Personalized Psychiatry: Foreign Experience in Psychopharmacogenetics. Lex Genetica. 2025;4(2):76-93. (In Russ.) https://doi.org/10.17803/lexgen-2025-4-2-76-93










